Grafito, fórmula molecular: C, peso molecular: 12,01, é unha forma de elemento carbono, cada átomo de carbono está conectado por outros tres átomos de carbono (dispostos en hexágonos de panal de mel) para formar unha molécula covalente. Porque cada átomo de carbono emite un electrón, os que poden moverse libremente, polo que o grafito é un condutor.
O grafito é un dos minerais máis brandos, e os seus usos inclúen a fabricación de minas de lapis e lubricantes. O carbono é un elemento non metálico situado no grupo IVA do segundo ciclo da táboa periódica. O grafito fórmase a altas temperaturas.
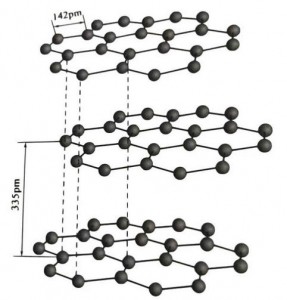
O grafito é un mineral cristalino de elementos de carbono, e a súa rede cristalina é unha estrutura en capas hexagonales. A distancia entre cada capa de malla é de 3,35 A e a separación dos átomos de carbono na mesma capa de malla é de 1,42 A. É un sistema de cristal hexagonal cunha escisión en capas completa. A superficie de escisión é principalmente enlaces moleculares, menos atractivos para as moléculas, polo que a súa flotación natural é moi boa.
Nos cristais de grafito, os átomos de carbono da mesma capa forman un enlace covalente coa hibridación sp2, e cada átomo de carbono está conectado a outros tres átomos en tres enlaces covalentes. Os seis átomos de carbono forman un anel de seis continuos no mesmo plano, estendéndose nunha estrutura de lamelas, onde a lonxitude do enlace do enlace CC é de 142 p.m., que está exactamente dentro do intervalo de lonxitude do enlace do cristal atómico, polo que para a mesma capa , é un cristal atómico. Os átomos de carbono no mesmo plano teñen unha órbita p, que se solapan entre si. Os electróns son relativamente libres, equivalentes aos electróns libres dos metais, polo que o grafito pode conducir a calor e a electricidade, que é a característica dos cristais metálicos. Así tamén clasificados como cristais metálicos.
A capa media de cristal de grafito está separada por 335 p.m. e a distancia é grande. Combínase coa forza de van der Waals, é dicir, a capa pertence ao cristal molecular. Non obstante, debido a que a unión dos átomos de carbono na mesma capa plana é moi forte e extremadamente difícil de destruír, o punto de disolución do grafito tamén é moi alto e as súas propiedades químicas son estables.
Tendo en conta o seu modo de unión especial, non se pode considerar como un só cristal ou policristal, agora o grafito considérase xeralmente como un cristal mixto.
Hora de publicación: 31-Xul-2023